A
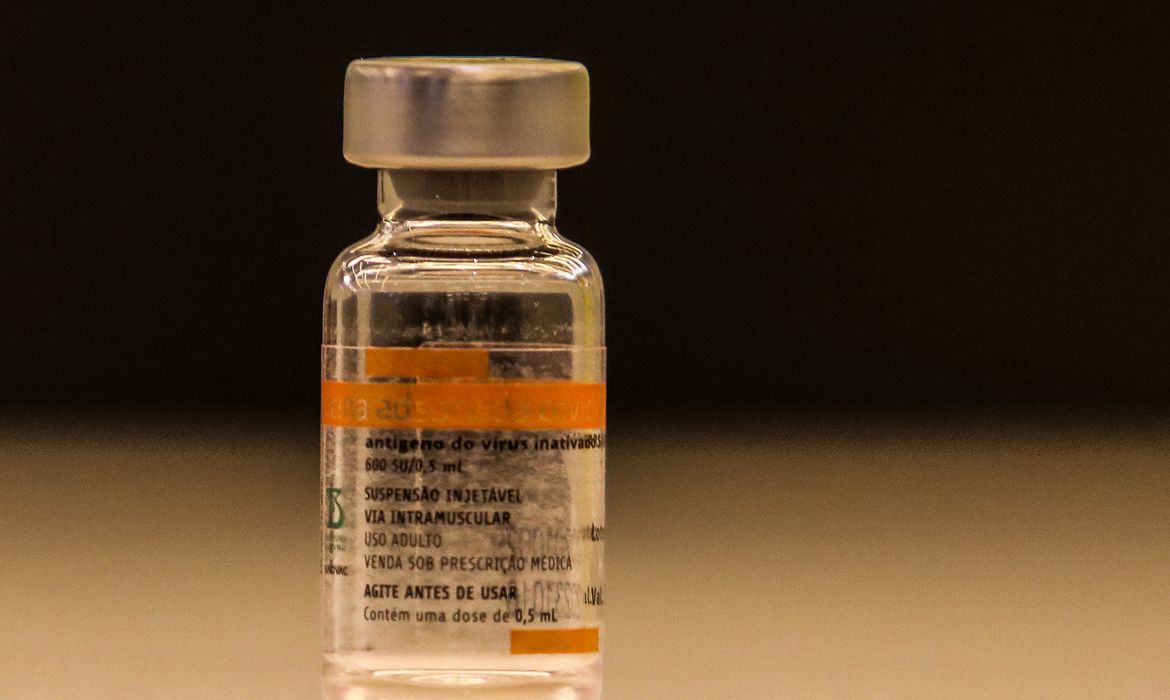
Agência Nacional de Vigilância Sanitária (Anvisa) determinou hoje (4) a interdição
cautelar de lotes da CoronaVac, proibindo a distribuição e uso de lotes que
foram envasados em uma fábrica não aprovada na autorização de uso emergencial
da vacina.
Em
nota, a agência explicou que, nesse caso, “configura-se em produto não
regularizado junto à Anvisa”, necessitando de atuação imediata para “mitigar um
possível risco sanitário” à população.
A
medida foi publicada neste sábado em edição
extra do Diário Oficial da União.
Butantan
Também
em nota, o Instituto Butantan, que distribui a vacina no Brasil, esclareceu que
a medida da Anvisa “não deve causar alarmismo”. “Foi o próprio instituto que,
por compromisso com a transparência e por extrema precaução, comunicou o fato à
agência, após atestar a qualidade das doses recebidas. Isso garante que os
imunizantes são seguros para a população”, explicou.
De
acordo com a Anvisa, o Instituto Butantan informou, ontem (3), que o
laboratório chinês Sinovac, fabricante da CoronaVac, enviou ao Brasil vacinas
envasadas em uma unidade que não foi inspecionada, nem aprovada pela agência
brasileira. São 25 lotes com um total de 12.113.934 de doses do imunizante.
Outros 17 lotes envasados no mesmo local, com 9 milhões de doses, estão em
tramitação de envio e liberação ao Brasil.
A
interdição cautelar tem o prazo de 90 dias. A Anvisa informou que, durante esse
período, “trabalhará na avaliação das condições de boas práticas de fabricação
da planta fabril não aprovada, no potencial impacto dessa alteração de local
nos requisitos de qualidade, segurança e eficácia, e do eventual impacto para as
pessoas que foram vacinadas com esse lote”.
Até
o momento, segundo a agência, não há relatórios de inspeção emitidos por outras
autoridades de referência, como o Esquema de Cooperação em Inspeção
Farmacêutica (PIC/S) e a Organização Mundial de Saúde (OMS).
Certificação
Além
disso, o Instituto Butantan deve regularizar o novo local na cadeia de
fabricação da vacina. O órgão informou que, há 15 dias, encaminhou à Anvisa
toda a documentação necessária para a certificação do processo de produção em
que foram feitas as referidas doses. “Por isso, tem convicção que ela será
concedida em breve. Caso necessário, pode complementar a solicitação com mais
dados, inclusive da Sinovac, caso a agência julgue necessário”, explicou,
reafirmando que todas as doses estão atestadas pelo rigoroso controle de
qualidade do Butantan.
A
Anvisa esclareceu que, na autorização de uso emergencial do imunizante,
aprovada em 17 de janeiro deste ano, consta que as vacinas devem ser
“importadas prontas da Sinovac, ou o granel da vacina formulada e estéril,
sendo importado da Sinovac para envase e acondicionamento no Instituto
Butantan. Entretanto, eventuais alterações nestas configurações devem
passar por nova análise das áreas técnicas da Anvisa”.
Agência Brasil




/i.s3.glbimg.com/v1/AUTH_59edd422c0c84a879bd37670ae4f538a/internal_photos/bs/2021/H/1/nYXAVtTTmYNDeiLOJ3sw/whatsapp-image-2021-09-04-at-12.01.53.jpeg)



%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia.jpg)
.png)

%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia.jpg)

%20-%20Copia%20-%20Copia.jpg)
%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia%20-%20Copia.jpg)